エンド-β-N-アセチルグルコサミニダーゼ (Endo-A, Endo-M)
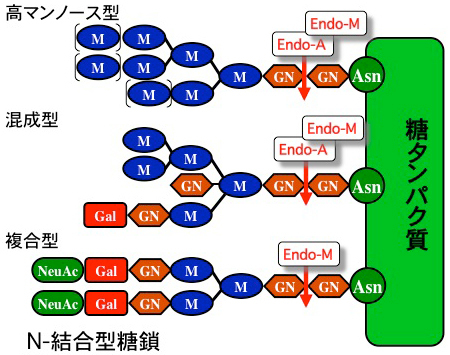
endo-β-N-acetylglucosaminidaseはN-結合型糖鎖の基本骨格を構成するN,N'-ジアセチルキトビオース構造(GlcNAcβ1,4 GlcNAc)を切断する酵素であり、糖質加水分解酵素(GH)のファミリー18と85に分類されている。GH85に属すendo-β-N-acetylglucosaminidaseの中で、Endo-A(Arthrobacter protophormiae由来) やEndo-M(Mucor hiemalis由来) は糖転移活性を有しており、糖鎖のすげ替え(remodeling)に利用することが可能である。ちなみに、B. longum NCC2705はGH85に属すendo-β-N-acetylglucosaminidaseをコードしている。ところが、我々が研究対象としているB. longum JCM1217にはコードされていない。これは、同じB. longum であっても異なる糖分解・代謝酵素を有していることを意味している。最近、コアフコースを有する複合型糖鎖を切断する酵素がB. infantisのGH18に属するendo-β-N-acetylglucosaminidaseから発見されたPubMed。B. longumにとっては不要と判断されたendo-β-N-acetylglucosaminidaseがB. infantisにとっては重要な酵素としてヒトミルク糖タンパク質の資化に関与しているようである。GH18だろうが85だろうが微生物にとってはどうでも良いことである。とにかく切ることが重要なのである。このような糖分解酵素遺伝子の多くは水平伝播により獲得していると考えられている。これは現在進行形で動いており、水平伝播と垂直伝播を繰り返す長い歴史の中で役に立つ遺伝子は固定化される。当然、環境が変われば役に立つ遺伝子はかわる。ミルクの存在する環境を好むB. infantisはミルクに含まれる糖鎖を切り、雑食環境を好むB. longumはendo-β-N-acetylglucosaminidaseを捨ててHRGPを切断する酵素群を発達させたのだろう。
【原著論文】
- Fujita, K., Sato, R., Toma, K., Kitahara, K., Suganuma, T., Yamamoto, K., and Takegawa, K.: Identification of the catalytic acid-base residue ofArthrobacter endo-β-N-acetylglucosaminidase by chemical rescue of an inactive mutant. J. Biochem., 142, 301-306 (2007).pubmed CAZypedia GH85 PDB
Chemical rescueの手法を用いてArthrobacter endo-β-N-acetylglucosaminidaseのGlu173が酸-塩基触媒サイトであることを明らかにした。
- Fujita, K., and Yamamoto, K. : A remodeling system for the oligosaccharide chains on glycoproteins with microbial endo-β-N-acetylglucosaminidases. Biochim. Biophis. Acta., 1760, 1631-1635 (2006). pubmed
Endo-Mの糖転移活性を利用して糖タンパク質の糖鎖を高マンノース型から複合型にすげ替えるリモデリングシステムを構築した。
- Fujita, K., Kobayashi, K., Iwamatsu, A., Takeuchi, M., Kumagai, H., and Yamamoto, K. : Molecular cloning of Mucor hiemalis endo-β-N-acetylglucosaminidase and some properties of the recombinant enzyme. Arch. Biochem. Biophys., 432, 41-49 (2004). pubmed GH85 GenBank
糸状菌(Mucor hiemalis)由来のendo-β-N-acetylglucosaminidase(Endo-M) のクローニングを行い、メタノール資化性酵母Candida boidiniiでの発現に成功した。また、本組換え酵素が複合型糖鎖に対する高い糖転移活性を有することを明らかにした。
【総説•著書】
- 竹川薫、藤田清貴:第7章 エンドAの構造から糖タンパク質合成の最適条件を探る、「バイオ医薬品開発における糖鎖技術」早川堯夫・掛樋一晃・平林 淳監修・シーエムシー出版、77-84(2011).シーエムシー出版
- Fujita, K., and Yamamoto, K.: Remodeling of Sugar Chains by Endo-M, inEndoglycosidases -Biochemistry, Biotechnology, Application-. Endo, M., Hase, S., Yamamoto, K., and Takagaki, K. (Eds.), Kodansha/Springer, Tokyo, 2006, pp. 159-162. 講談社
糖タンパク質の糖鎖を根元から切り落とす"はさみ"としての働きをするエンドグリコシダーゼが持つ糖転移活性の利用法について解説した。
- 藤田清貴,山本憲二:微生物酵素を用いた糖タンパク質糖鎖の自由なモデリング,化学と生物,41, 244-249 (2003). Journal@rchive (全文)
糖タンパク質の糖鎖を根元から切り落とす"はさみ"としての働きをするエンドグリコシダーゼが持つ糖転移活性を"のり"として利用することにより、糖鎖を自由に導入して糖ペプチドや糖タンパク質を合成する試みについて総説した。
【Web】
 ビフィズス菌が持つ糖タンパク質糖鎖分解酵素の解析
藤田清貴/ 応用糖質化学研究室
ビフィズス菌が持つ糖タンパク質糖鎖分解酵素の解析
藤田清貴/ 応用糖質化学研究室
